MCT: risorsa nutraceutica dalle molteplici applicazioni metaboliche


I trigliceridi a catena media sono interessantissime risorse nutraceutiche dalle importanti possibilità applicative in una notevole gamma di applicazioni (1), che meritano un approfondito esame relativamente alle più concrete possibilità di impiego.
MCT: Cosa sono
I trigliceridi a catena media o MCT sono complessi di acidi grassi saturi di lunghezza compresa tra 6 e 10 atomi di carbonio o MCFAs (Caproico C6:0, Caprilico C8:0 e Caprico C10:0 – l’acido laurico C12:0 viene comunemente considerato un MCT ma in realtà mostra proprietà intermedie quindi non lo è a tutti gli effetti) e glicerolo (2-3). Dal punto di vista alimentare gli MCT in natura non sono distribuiti in grandi quantità; le fonti relativamente più ricche sono
- Acido Caproico: burro 2%, vari tipi di formaggio 0,5%
- Acido Caprilico: nell’olio di cocco 6,8%, olio di palmisto 3,3%
- Acido Caprico: olio di cocco (5,4%), olio di palmisti (3,7%), formaggio di capra (3,4%) e burro (2,5%).
Gli MCFAs hanno un punto di fusione decisamente più basso rispetto ad acidi grassi a catena più lunga, rimanendo in forma liquida a temperatura ambiente, le loro piccole dimensioni inoltre permettono una solubilità decisamente superiore rispetto a ad acidi grassi di lunghezza maggiore (4), permettendo una maggiore varietà di formulazione.
Le fonti di MCT generalmente impiegate nella supplementazione sono una miscela di acido caprilico (50-60%) e caprico (20-50%), ottenuti dalla lavorazione di olio di cocco e/o di olio di palmisto, che in seguito a separazione e distillazione forniscono MCFAs che miscelati in adeguate proporzioni con glicerolo daranno origine agli MCT desiderati, questi processi possono includere sia l’impiego di solventi chimici che di specifici enzimi (lipasi) (5).
MCT Sicurezza e tossicologia
Valutazioni sul modello animale con alti dosaggi di MCT (un singolo bolo di 36 ml / kg e la somministrazione giornaliera di 21,3 ml / kg in 30 giorni) non hanno permesso di stabilire una DL50 (6). Questo diventa particolarmente significativo considerando che un un bolo di 36 ml / kg nei ratti corrisponde a una dose equivalente umana di 5,8 ml / kg, cioè circa 400 ml (1,7 tazze) per un adulto di 70 kg (7). Anche la somministrazione in cronico di MCT pari al 5% delle calorie assunte per 3 mesi non è stata correlata ad alcun effetto avverso (6). Le cose invece non stanno così assumendo singolarmente acido caprilico e acido caproico che mostrano rispettivamente nel ratto una dL50 di 1,41 mL / kg e 3,73 mL / kg (6).
MCT Digestione e assorbimento
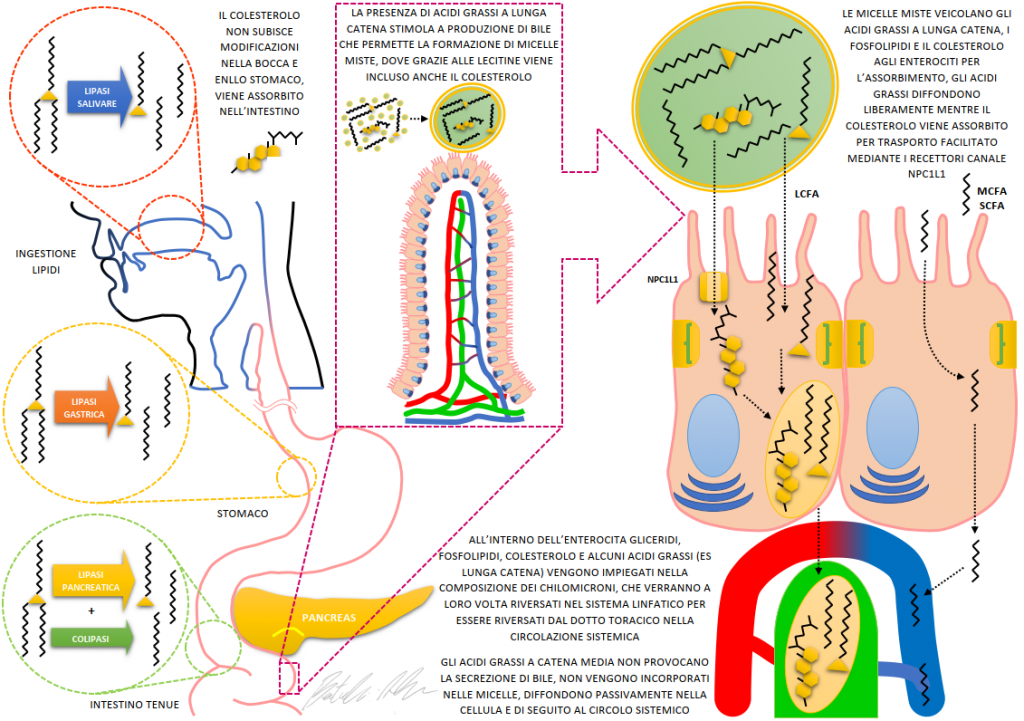
La digestione di tutti i trigliceridi inizia a livello della bocca e dello stomaco, per azione delle lipasi linguali e gastriche, la lunghezza degli acidi grassi presenti nei trigliceridi non sembra influenzare la velocità di svuotamento gastrico (7) mentre esercita profonde differenze nei successivi processi di digestione. Una volta arrivati nel piccolo intestino, la lunghezza degli acidi grassi esercita profonde differenze:
- Acidi grassi a lunga catena (LCFAs): stimolano il rilascio di bile e lipasi pancreatica, vengono emulsionati, inclusi nei chilomicroni che vengono a loro volta assorbiti dalle cellule intestinali, metabolizzati e veicolati attraverso il sistema linfatico (8)
- Acidi grassi a catena media (MCFAs): Non stimolano la secrezione di bile o di succo pancreatico (9-11), non vengono inclusi nei chilomicroni perché diffondono passivamente prima a livello delle cellule intestinali, poi nel circolo enterico da cui vengono veicolate a quello portale (12), entrando immediatamente nel circolo ematico e non in quello linfatico. Queste dinamiche rendono l’assorbimento degli acidi grassi a catena media un processo decisamente rapido, qualcosa di molto più simile a quello che avviene per il glucosio (13) piuttosto che agli acidi grassi a lunga catena.
L’assunzione in acuto di 40 g di MCT non si dimostra in grado di stimolare la produzione di chilomicroni, confermando la rapidità delle dinamiche di assorbimento (14). Le cose cambiano notevolmente quando la dieta viene modificata assumendo per tempistiche prolungate alti dosaggi di MCT; ottenendo dagli MCT il 40% del fabbisogno energetico giornaliero per 5 giorni si osserva come gli MCFAs arrivino a costituire una quota compresa tra il 7 e il 22% del contenuto dei chilomicroni, suggerendo come l’assorbimento di alti quantitativi finisca con l’interessare anche dinamiche più lente caratteristiche degli LCFAs (15). La lunghezza degli acidi grassi è l’elemento determinante nella digestione e assorbimento, basti pensare che nonostante l’assunzione di una quantità di acido caprilico doppia rispetto all’acido caprico, l’assorbimento dell’acido caprico si rivela dalle 3 alle 4 volte superiore (15).
MCT Metabolismo
Le dinamiche di ingresso nella circolazione portale degli MCFAs in precedenza descritto provocano un assorbimento quasi esclusivamente a carico del fegato, con un minimale interessamento del circolo sistemico (12), mentre i LCFAs interessando il circolo linfatico vengono distribuiti tra fegato, muscoli organo adiposo ed altri distretti. Una volta all’interno del fegato gli MCFAs sono in grado di attraversare rapidamente le membrane mitocondriali, senza necessariamente richiedere l’intervento della carnitina, e di essere rapidamente veicolati alla beta ossidazione (16). La notevole produzione di acetil-CoA che ne deriva ne permette l’impiego in numerose vie metaboliche tra cui principalmente (17)
- Ciclo di Krebs e successiva fosforilazione ossidativa: con produzione di ATP (fattore limitato dalla disponibilità di ossaloacetato (18), per questo nei prodotti per lo sport viene inclusa anche una quota di carboidrati)
- Chetogenesi: l’acetilCoA non impiegato nella fase precedente viene utilizzato per la produzione di corpi chetonici, questo impiego è inversamente proporzionale all’utilizzo nel ciclo di Krebs.
Si dimostra estremamente significativo come l’eccesso di acetil-CoA non utilizzato nel ciclo di Krebs viene veicolato nella produzione di chetoni con un contributo minimo o assente alla produzione e l’accumulo di nuovi acidi grassi, questo anche in presenza di alti livelli di ormoni con effetto regolatorio opposto rispetto alla chetosi come l’insulina (19-22). L’acido caprilico sembra essere quello maggiormente efficace nell’indurre e favorire la chetosi (23).
MCT e sistema nervoso
Modulazione dell’appetito
Gli MCFAs attraversano rapidamente la barriera ematoencefalica con una combinazione di diffusione passiva e trasporto, l’acido caprico agisce come antagonista competitivo dei recettori AMPA (24-25) .Diversi studi mostrano interessanti effetti sulla modulazione dell’appetito, mediamente l’assunzione di quote comprese tra 10 e 40 g di MCT è correlata a una riduzione dell’assunzione calorica nei pasti successivi compresa tra le 40 e le 165 kCal, rispetto a analoghe somministrazioni di altre fonti lipidiche (26-29). Si dimostra molto interessante uno studio randomizzato, crossover su 6 uomini sani dove è stato osservato che variando il rapporto tra MCFAs e LCFAs da 0.5:1 a 2:1, mantenendo invariate l’assunzione complessiva di grassi e degli altri macronutrienti per 2 settimane si assiste a una significativa riduzione nell’assunzione alimentare stimata mediamente in 250 kCal al giorno (30)
Memoria e apprendimento
La possibilità di incrementare la produzione di corpi chetonici è alla base dei diversi studi preliminari effettuati relativamente alla possibilità degli MCT di supportare la funzione cognitiva (31-33). Uno studio doppio cieco crossover che ha preso in considerazione 20 soggetti anziani con deficit cognitivo lieve-moderato e possibile malattia di Alzheimer ha riportato come il consumo di 40 ml di MCT sotto forma di olio è stata correlata a un significativo miglioramento del punteggio sulla Alzheimer’s Disease Assessment Scale-Cognitive Subscale (ADAS-cog) rispetto al consumo di un’altra forma di lipidi (31). Un successivo studio effettuato su 140 soggetto con diagnosi di malattia di Alzheimer ha dimostrato come il consumo di 20 g di MCT sotto forma di olio per 90 giorni sia correlato a un notevole miglioramento del punteggio sulla Alzheimer’s Disease Assessment Scale-Cognitive Subscale (ADAS-cog) dopo 45 giorni di assunzione, mantenuti a livelli simili anche a 90 giorni (32).
MCT e metabolismo del glucosio
Diversi studi riportano effetti positivi anche relativamente al metabolismo del glucosio. Uno studio successivamente replicato ha dimostrato che il consumo di 1 g / kg di olio MCT ha dimostrato in adulti sani di poter aumentare i livelli insulinici a digiuno da 9,3 µU / mL a 17,7 dopo 30 minuti, 15,3 dopo un’ora e 15,4 dopo due ore dall’assunzione, con un declino progressivo che inizia al termine della seconda ora (33-35) Questo è stato associato a una significativa riduzione della glicemia quantificabile in circa 6-8 mg / dL. Un ulteriore lavoro su un contenuto numero di pazienti affetti da diabete di tipo 2 (10) ha dimostrato un significativo incremento nella produzione insulinica in seguito alla somministrazione di 40 g di MCT protratta per 4 giorni, producendo dati indicativi di un miglior assorbimento periferico di glucosio (36). Un ulteriore valutazione randomizzata e controllata di 90 giorni in cui sono stati somministrati 18 g di MCT contro 18 g di un’altra fonte lipidica in pazienti affetti da diabete di tipo 2 ha dimostrato un miglioramento dell’insulino sensibilità del 17% contestualmente al miglioramento dell’indice HOMA, contro un miglioramento del 7% riscontrato nel gruppo controllo. Inoltre il gruppo trattato con MCT ha dimostrato una significativa perdita di peso associata l miglioramento dell’insulino-sensibilità (37) .
MCT sovrappeso e obesità
Meccanismi implicati
Il consumo di MCT rispetto ad acidi grassi a catena lunga sembra essere correlato ad una migliore ossidazione dei substrati di natura lipidica dimostrata sia nel modello animale (38-40) sia nel modello umano (41-43). Inoltre il consumo di MCT sembra implementare nel modello umano anche l’ossidazione degli acidi grassi a catena lunga oltre che degli stessi MCT (44), fattore molto interessante nel trattamento dell’obesità dato che è dimostrato come il soggetto obeso tenda ad avere ridotte capacità di ossidazione degli acidi grassi a catena lunga rispetto alle controparti magre (45). Questo si ritiene possa essere correlato all’enzima carnitina palmitoiltransferasi (CPT) elemento limitante nella velocità di ossidazione degli acidi grassi a catena lunga (46). Studi effettuati su modelli animali sovralimentati riportano un minor incremento di peso quando la quota lipidica è rappresentata da MCT rispetto ad acidi grassi a catena lunga (47-50).
Chetogenesi
Valutazioni effettuate su soggetti obesi (BMI > 30) dimostrano come l’ingestione di 9.9 g di MCT nel contesto di una dieta fortemente ipocalorica sia associato a un maggiore incremento ematico di corpi chetonici (beta idrossi-butirrato) contestualmente a una minore escrezione di azoto, suggerendo un netto effetto anticatabolico con risparmio di proteico; infatti la perdita di peso valutata in 2 settimane nel gruppo che ha assunto MCT interessava la massa grassa in percentuale superiore (pari al 56%) rispetto il gruppo che ha assunto acidi grassi a catena lunga (pari al 22%) e al gruppo che ha effettuato una dieta ipolipidica (pari al 25%) (47) .
Riscontri clinici
Gli effetti in precedenza discussi mostrano anche interessanti risposte in ambito clinico. Uno studio doppio cieco, controllato sul modello umano, dove sono stati valutati sia soggetti di sesso maschile sia soggetti di sesso femminile con BMI > 23 ha dimostrato che Il consumo di 10 g di MCT nel contesto di una dieta contenente 60 g di lipidi è stato correlato a una maggiore perdita di tessuto adiposo (- 3.86,6 ± 0.3 kg contro -2.75 ± 0.2 kg) in particolar modo a livello sottocutaneo rispetto al consumo di una quota lipidica contenente solo LCT (48). Il consumo di 18 g/giorno di MCT per 90 giorni in soggetti sovrappeso o obesi affetti da diabete di tipo 2 è correlato a una maggiore perdita di peso, riduzione della circonferenza della vita e notevole miglioramento del profilo metabolico (49) .
Una review che ha preso in considerazione trials randomizzati, controllati , condotti in adulti sani che hanno preso in considerazione la sostituzione di LCT con MCT (impiagati a dosaggi compresi tra 5 a 48 g MCT/giorno) è correlata a perdita di peso, riduzione della circonferenza della vita e dei fianchi, riduzione della massa grassa totale, del grasso sottocutaneo e viscerale senza effetti avversi sulla lipidemia (50).
Sono stati dimostrati vantaggi nel modello animale anche nel contesto di una dieta ad alto tenore lipidico, somministrando il 2% di MCT + 2% di LCT rispetto al 4% di LCT si verifica una diminuzione del peso corporeo e della massa grassa, dovuta secondo gli autori all’attivazione del tessuto adiposo bruno (51) , fattore che se confermato nel modello umano renderebbe l’applicazione degli MCT ancora più vantaggiosa nel dimagrimento. Oltre a questa potenzialità applicativa sul tessuto adiposo bruno l’assunzione di MCT è stata correlata anche a un miglioramento del microbiota intestinale e delle giunzioni serrata in soggetti in condizione dismetabolica, ponendo le basi per un una dinamica di assorbimento intestinale più fisiologica (52), suggerendo il ruolo degli MCT come lipidi bioattivi. Dato che l’assunzione di MCT favorisce come illustrato in precedenza anche il consumo di LCT metabolizzati nel mitocondrio grazie, la contestuale assunzione di carnitina può dimostrarsi di particolare interesse, inoltre l’assunzione di carnitina si dimostra interessante anche per il suo ruolo nell’attivazione della chetosi (53).
MCT esercizio e performace
Anche dal punto di vista della performance gli MCT mostrano interessanti possibilità applicativa, uno studio doppio cieco crossover effettuato su 8 soggetti sani dimostra come l’assunzione di 6 g/die di MCT per 2 settimane precedenti la valutazione, rispetto all’assunzione di LCT è correlata a una minore utilizzazione dei carboidrati per la produzione di energia con minore produzione di lattato prolungando la capacità di esercizio (54) .
Una valutazione eseguita su ciclisti ha evidenziato come l’assunzione di 600 mL/h di una soluzione contenente 10% glucosio + 3.44% MCT previo periodo di 15 giorni di dieta iperlipidica è correlata a una maggiore capacità di utilizzo dei lipidi, rispetto a un gruppo di controllo che nei 15 giorni precedenti ha continuato a seguire l’alimentazione abituale (55) .
Studi preliminari sul modello animale sembrano indicare che il consumo di MCT sia associato a notevoli benefici sulla performance dovuti anche all’incremento del metabolismo e della biogenesi mitocondriale, fattore che se confermato nel modello umano potrebbe, insieme a quelli descritti in precedenza per le altre funzioni biologiche, costituire un importante obiettivo da percorrere nello sviluppo della capacità di performance metabolica e sportiva dell’organismo (56) .
BIBLIOGRAFIA
- https://examine.com/supplements/MCTs/research/#citations
- Babayan V. Medium chain length fatty acid esters and their medical and nutritional applications. J Am Oil Chem Soc. (1981)
- Sigalet DL, Winkelaar GB, Smith LJ. Determination of the route of medium-chain and long-chain fatty acid absorption by direct measurement in the rat. JPEN J Parenter Enteral Nutr. (1997)
- Bach AC, Babayan VK. Medium-chain triglycerides: an update. Am J Clin Nutr. (1982)
- Ghosh S, Bhattacharyya DK. Medium-chain fatty acid-rich glycerides by chemical and lipase-catalyzed polyester-monoester interchange reaction. J Amer Oil Chem Soc. (1997)
- Traul KA, et al. Review of the toxicologic properties of medium-chain triglycerides. Food Chem Toxicol. (2000)
- Nair AB, Jacob S. A simple practice guide for dose conversion between animals and human. J Basic Clin Pharm. (2016)
- Mu H, Porsgaard T. The metabolism of structured triacylglycerols. Prog Lipid Res. (2005)
- Mansbach CM 2nd, Gorelick F. Development and physiological regulation of intestinal lipid absorption. II. Dietary lipid absorption, complex lipid synthesis, and the intracellular packaging and secretion of chylomicrons. Am J Physiol Gastrointest Liver Physiol. (2007)
- McLaughlin J, et al. Fatty acid chain length determines cholecystokinin secretion and effect on human gastric motility. Gastroenterology. (1999)
- Symersky T, et al. The effect of equicaloric medium-chain and long-chain triglycerides on pancreas enzyme secretion. Clin Physiol Funct Imaging. (2002)
- You YQ, et al. Effects of medium-chain triglycerides, long-chain triglycerides, or 2-monododecanoin on fatty acid composition in the portal vein, intestinal lymph, and systemic circulation in rats. JPEN J Parenter Enteral Nutr. (2008)
- Iber FL. Relative rates of metabolism MCT, LCT and ethanol in man. Z Ernahrungswiss Suppl. (1974)
- Borel P, et al. Chylomicron beta-carotene and retinyl palmitate responses are dramatically diminished when men ingest beta-carotene with medium-chain rather than long-chain triglycerides. J Nutr. (1998)
- Swift LL, et al. Medium-chain fatty acids: evidence for incorporation into chylomicron triglycerides in humans. Am J Clin Nutr. (1990)
- Rubio-Gozalbo ME, et al. Carnitine-acylcarnitine translocase deficiency, clinical, biochemical and genetic aspects. Mol Aspects Med. (2004)
- Bach A, Phan T, Metais P. Effect of the fatty acid composition of ingested fats on rat liver intermediary metabolism. Horm Metab Res. (1976)
- Bach A. Oxaloacetate deficiency in MCT-induced ketogenesis. Arch Int Physiol Biochim. (1978)
- McGarry JD, Foster DW. Regulation of hepatic fatty acid oxidation and ketone body production. Annu Rev Biochem. (1980)
- Yeh YY, Zee P. Relation of ketosis to metabolic changes induced by acute medium-chain triglyceride feeding in rats. J Nutr. (1976)
- Bach A, et al. Ketogenic response to medium-chain triglyceride load in the rat. J Nutr. (1977)
- McGarry JD, Foster DW. The regulation of ketogenesis from octanoic acid. The role of the tricarboxylic acid cycle and fatty acid synthesis. J Biol Chem. (1971)
- Vandenberghe C, et al. Tricaprylin alone increases plasma ketone response more than coconut oil or other medium chain triglycerides: an acute crossover study in healthy adults. Curr Dev Nutr. (2017)
- Adkison KD, Shen DD. Uptake of valproic acid into rat brain is mediated by a medium-chain fatty acid transporter. J Pharmacol Exp Ther. (1996)
- Chang P, et al. Seizure control by decanoic acid through direct AMPA receptor inhibition. Brain. (2016)
- Van Wymelbeke V, Louis-Sylvestre J, Fantino M. Substrate oxidation and control of food intake in men after a fat-substitute meal compared with meals supplemented with an isoenergetic load of carbohydrate, long-chain triacylglycerols, or medium-chain triacylglycerols. Am J Clin Nutr. (2001)
- Rolls BJ, et al. Food intake in dieters and nondieters after a liquid meal containing medium-chain triglycerides. Am J Clin Nutr. (1988)
- St-Onge MP, et al. Impact of medium and long chain triglycerides consumption on appetite and food intake in overweight men. Eur J Clin Nutr. (2014)
- Van Wymelbeke V, et al. Influence of medium-chain and long-chain triacylglycerols on the control of food intake in men. Am J Clin Nutr. (1998)
- Stubbs RJ, Harbron CG. Covert manipulation of the ratio of medium- to long-chain triglycerides in isoenergetically dense diets: effect on food intake in ad libitum feeding men. Int J Obes Relat Metab Disord. (1996)
- Reger MA, et al. Effects of beta-hydroxybutyrate on cognition in memory-impaired adults. Neurobiol Aging. (2004)
- Henderson ST, et al. Study of the ketogenic agent AC-1202 in mild to moderate Alzheimer’s disease: a randomized, double-blind, placebo-controlled, multicenter trial. Nutr Metab (Lond). (2009)
- Cunnane SC, et al. Can Ketones Help Rescue Brain Fuel Supply in Later Life? Implications for Cognitive Health during Aging and the Treatment of Alzheimer’s Disease. Front Mol Neurosci. (2016)
- Pi-Sunyer FX, Hashim SA, Van Itallie TB. Insulin and ketone responses to ingestion of medium and long-chain triglycerides in man. Diabetes. (1969)
- Tamir I, et al. Effects of a single oral load of medium-chain triglyceride on serum lipid and insulin levels in man. J Lipid Res. (1968)
- Eckel RH, et al. Dietary substitution of medium-chain triglycerides improves insulin-mediated glucose metabolism in NIDDM subjects. Diabetes. (1992)
- Han JR, et al. Effects of dietary medium-chain triglyceride on weight loss and insulin sensitivity in a group of moderately overweight free-living type 2 diabetic Chinese subjects. Metabolism. (2007)
- Souza PF, Williamson DH. Effects of feeding medium-chain triacylglycerols on maternal lipid metabolism and pup growth in lactating rats. Br J Nutr. (1993)
- Lieber CS, et al. Difference in hepatic metabolism of long- and medium-chain fatty acids: the role of fatty acid chain length in the production of the alcoholic fatty liver. J Clin Invest. (1967)
- Johnson RC, et al. Medium-chain-triglyceride lipid emulsion: metabolism and tissue distribution. Am J Clin Nutr. (1990)
- Watkins JB, et al. Diagnosis and differentiation of fat malabsorption in children using 13C-labeled lipids: trioctanoin, triolein, and palmitic acid breath tests. Gastroenterology. (1982)
- Metges CC, Wolfram G. Medium- and long-chain triglycerides labeled with 13C: a comparison of oxidation after oral or parenteral administration in humans. J Nutr. (1991)
- Schoeller DA, et al. 13C abundances of nutrients and the effect of variations in 13C isotopic abundances of test meals formulated for 13CO2 breath tests. Am J Clin Nutr. (1980)
- Papamandjaris AA, et al. Endogenous fat oxidation during medium chain versus long chain triglyceride feeding in healthy women. Int J Obes Relat Metab Disord. (2000)
- Binnert C, et al. Influence of human obesity on the metabolic fate of dietary long- and medium-chain triacylglycerols. Am J Clin Nutr. (1998)
- Carnitine Palmitoyltransferase 1A Deficiency.
- Krotkiewski M. Value of VLCD supplementation with medium chain triglycerides. Int J Obes Relat Metab Disord. (2001)
- Tsuji, H., Kasai, M., Takeuchi, H., Nakamura, M., Okazaki, M., Kondo, K., 2001. Dietary Medium-Chain Triacylglycerols Suppress Accumulation of Body Fat in a Double-Blind, Controlled Trial in Healthy Men and Women. The Journal of Nutrition 131, 2853–2859 https://doi.org/10.1093/jn/131.11.2853
- Han, J.R., Deng, B., Sun, J., Chen, C.G., Corkey, B.E., Kirkland, J.L., Ma, J., Guo, W., 2007. Effects of dietary medium-chain triglyceride on weight loss and insulin sensitivity in a group of moderately overweight free-living type 2 diabetic Chinese subjects. Metabolism 56, 985–991. https://doi.org/10.1016/j.metabol.2007.03.005
- Mumme, K., Stonehouse, W., 2015. Effects of Medium-Chain Triglycerides on Weight Loss and Body Composition: A Meta-Analysis of Randomized Controlled Trials. Journal of the Academy of Nutrition and Dietetics 115, 249–263. https://doi.org/10.1016/j.jand.2014.10.022
- Zhang Y, Xu Q, Liu YH, Zhang XS, Wang J, Yu XM, Zhang RX, Xue C, Yang XY, Xue CY. Medium-Chain Triglyceride Activated Brown Adipose Tissue and Induced Reduction of Fat Mass in C57BL/6J Mice Fed High-fat Diet. Biomed Environ Sci. 2015 Feb;28(2):97-104. doi: 10.3967/bes2015.012. PMID: 25716560
- Rial, S., Karelis, A., Bergeron, K.-F., Mounier, C., 2016. Gut Microbiota and Metabolic Health: The Potential Beneficial Effects of a Medium Chain Triglyceride Diet in Obese Individuals. Nutrients 8, 281. https://doi.org/10.3390/nu8050281
- Di Donato S, Peluchetti D, Rimoldi M, Bertagnolio B, Uziel G, Cornelio F. Ketogenic response to fasting in human carnitine deficiencies. Clin Chim Acta. 1980 Jan 31;100(3):209-14. doi: 10.1016/0009-8981(80)90268-5. PMID: 7353309
- Nosaka N, Suzuki Y, Nagatoishi A, Kasai M, Wu J, Taguchi M. Effect of ingestion of medium-chain triacylglycerols on moderate- and high-intensity exercise in recreational athletes. J Nutr Sci Vitaminol (Tokyo). 2009 Apr;55(2):120-5. doi: 10.3177/jnsv.55.120.
- Goedecke JH, et al. Metabolic adaptations to a high-fat diet in endurance cyclists. Metabolism. 1999. PMID: 10599981 Clinical Trial.
- Wang Y, Liu Z, Han Y, Xu J, Huang W, Li Z. Medium Chain Triglycerides enhances exercise endurance through the increased mitochondrial biogenesis and metabolism. PLoS One. 2018 Feb 8;13(2):e0191182. doi: 10.1371/journal.pone.0191182. eCollection 2018. PMID: 29420554